以CRISPR-Cas9、Cas12a为代表的基因组编辑系统在植物研究和作物改良中已被广泛应用,然而噬菌体、细菌中与之伴生的anti-CRISPR(Acr)蛋白在基因组编辑基础研究及应用实践中的潜力仍待明确界定。近日,SCIENCE CHINA Life Sciences杂志在线发表了由西南大学张勇课题组及其合作团队撰写的“Versatile plant genome engineering using anti-CRISPR-Cas12a systems”研究论文。该研究基于type V Acr蛋白与Cas12a核酸酶,设计了type V型Acr蛋白和Cas12a核酸酶共表达策略的植物基因组编辑新系统,分析Acr蛋白对Cas12a植物基因编辑活性和特异性的影响,实现了水稻内源基因高特异性有效编辑,并构建了植物基因组合成生物学基因表达调控逻辑回路,进一步丰富了植物基因组编辑工具库。全文主要研究结果如下:

1、 Anti-CRISPR-Cas12a在大肠杆菌中的编辑表征
为了识别新的Anti-CRISPR(Acr)基因,作者开发了一个整合了五个特征的决策树模型(图1A)在细菌中鉴定出六个与已鉴定Acr蛋白典型范围分布重叠的候选新Acr基因(图1B),进一步应用质粒干扰实验在大肠杆菌中研究不同Acr蛋白对Mb2Cas12a和LbCas12a的抑制效果(图1D)。实验结果表明,对于Mb2Cas12a,AcrVA1显示出最明显的抑制效果,其次是AcrVA5,而AcrVA4在大肠杆菌中几乎没有显示出任何抑制活性(Fig. 1E和1F);LbCas12a被AcrVA1强烈抑制,其余Acr蛋白在大肠杆菌中未能显示出抑制活性(Fig. 1G和1H)。
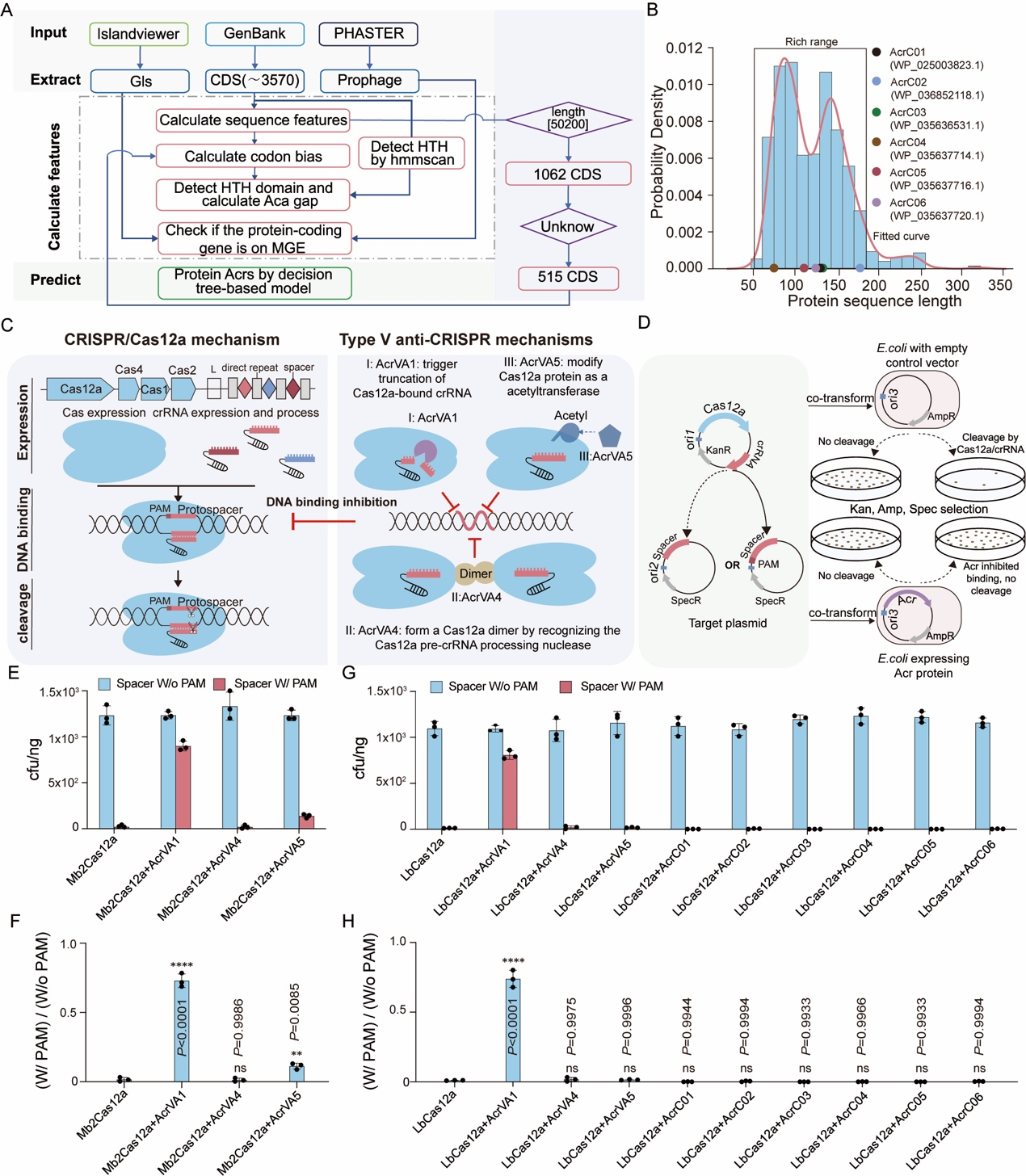
图1 多种Anti-CRISPR-Cas12a系统的细菌编辑特性
2、 Acr蛋白在植物中阻止LbCas12a及Mb2Cas12a介导的基因组编辑
水稻原生质体中,AcrVA1显著降低了LbCas12a的编辑效率,而其他Acr蛋白未显示明显抑制效果(图2A,2B)。水稻稳定转化实验中,AcrVA1共表达显著抑制了LbCas12a在OsPDS-cR01位点的基因编辑效率,而AcrVA4和AcrC03也表现出一定程度的抑制效果,这表明植物稳定转化系统对检测Acr蛋白潜在抑制效果更为敏感(图2C,2D)。作者进一步在多个位点比较了AcrVA1、AcrVA4、AcrVA5和AcrC03对LbCas12a的抑制效果:水稻原生质体中,AcrVA1在所有四个目标位点上都显示出对LbCas12a的非常强的抑制作用,AcrVA4和AcrVA5在部分位点显示出抑制作用(图2E);水稻稳定转化结果分析显示,AcrVA1共表达后,编辑效率显著降低(图2F),AcrVA4或AcrVA5共表达后,所有四个位点的编辑效率也有所下降,但程度较小(图2F)。这些数据表明,AcrVA1是一个非常有效的抗LbCas12a蛋白,其抑制效果远超过其他测试的Acr蛋白。
为了探究上述观察结果的普遍性,作者在相同的四个位点测试了AcrVA1、AcrVA4、AcrVA5和AcrC03在水稻中对Mb2Cas12a的多重编辑的抑制效果。与LbCas12a的情况类似,在水稻原生质体中,AcrVA1显著抑制了Mb2Cas12a的基因组编辑活性(图2G),而在稳定转化植株中,当AcrVA1共表达时,在所有四个目标位点上都没有检测到单个编辑(图2H)。
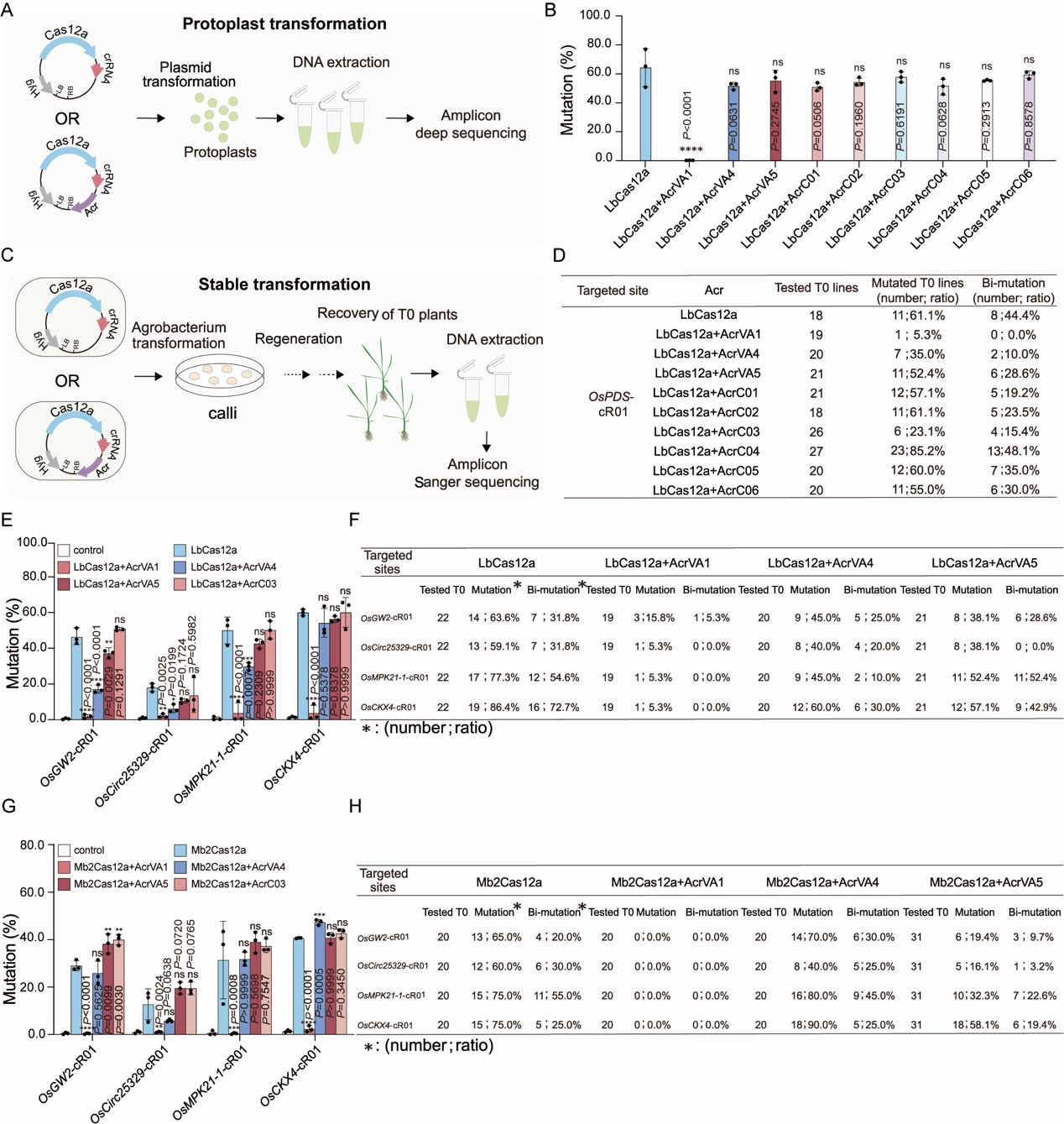
图2 通过anti-CRISPR系统有效抑制LbCas12a和Mb2Cas12a植物基因组原位编辑
3、 AcrVA1降低LbCas12a在水稻中的编辑脱靶效应
通过对19个T0代水稻植株进行全基因组测序(WGS),包括单独LbCas12a编辑的植株、LbCas12a+AcrVA1共编辑的植株、LbCas12a+AcrVA5共编辑的植株以及对照植株(图3A,3B)。测序结果表明,AcrVA1显著减少了LbCas12a的全基因组脱靶效应(图3C-3F),而AcrVA5则轻微减少了脱靶突变(图3C,3D,3F)。这些突变广泛分布于基因组的各个区域,尤其是在基因间和重复区域(图3E和3G)。通过Cas-OFFinder预测crRNA脱靶位点和WGS数据分析,证实了AcrVA1和AcrVA5能减轻LbCas12a在水稻中的脱靶效应(图3H)。
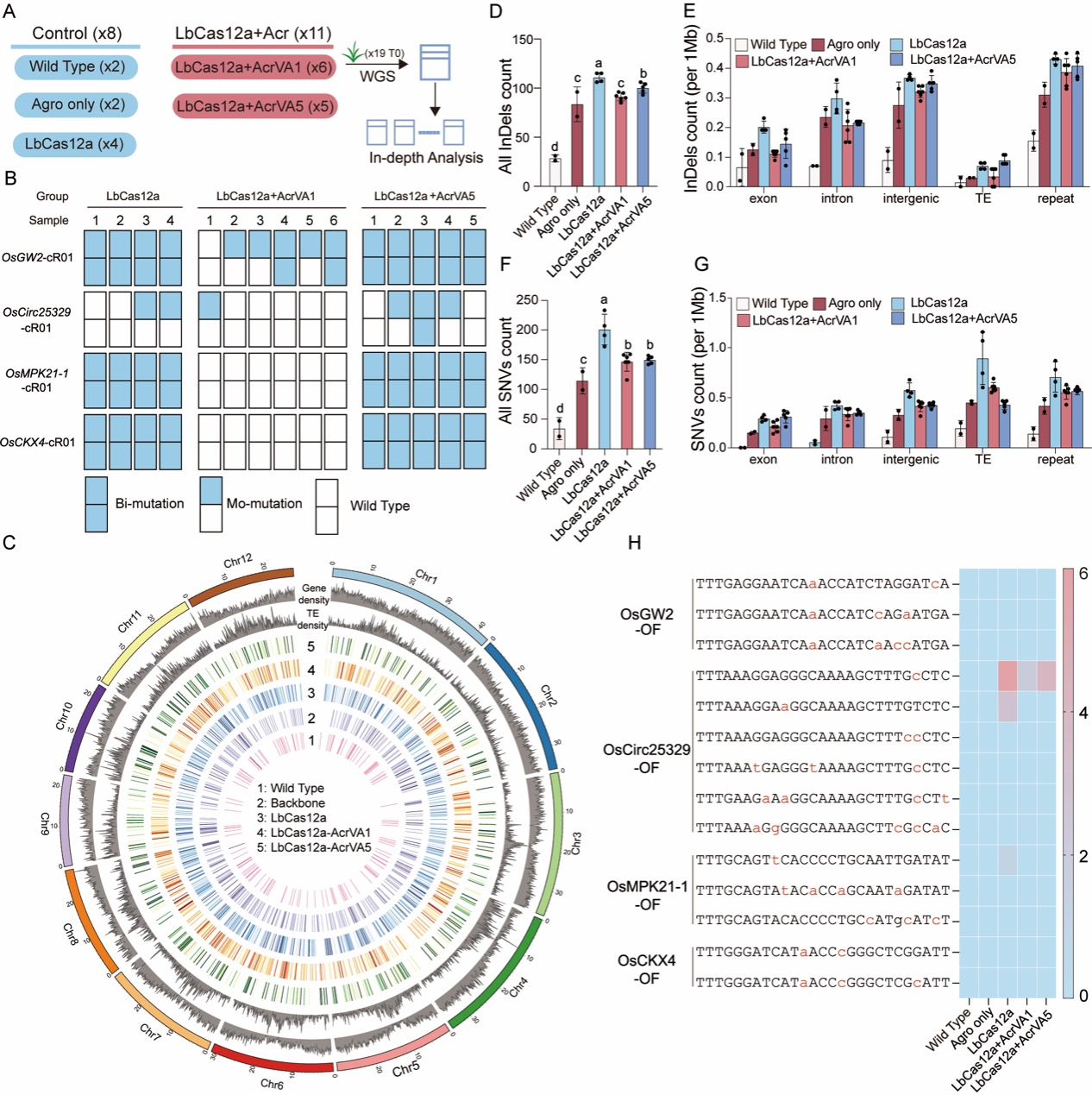
图3 全基因组测序结果显示AcrVA1在水稻中显著降低LbCas12a的脱靶效应
4、 通过AcrVA1的组成型表达微调水稻LbCas12a基因组编辑
利用AcrVA1对LbCas12a基因编辑系统的抑制特性,作者通过顺序转化法在水稻中微调LbCas12a基因编辑效率(图4A)。首先筛选出稳定表达AcrVA1的水稻,然后这些植株再次转化以引入CRISPR-LbCas12a编辑系统(图4A和4B)。分析显示,AcrVA1的表达水平与基因编辑效率成反比,高表达AcrVA1的植株编辑效率大幅下降(图4C)。这表明AcrVA1能显著调节基因编辑特异性和效率,为提高基因编辑的精确度提供了新策略(图4D)。
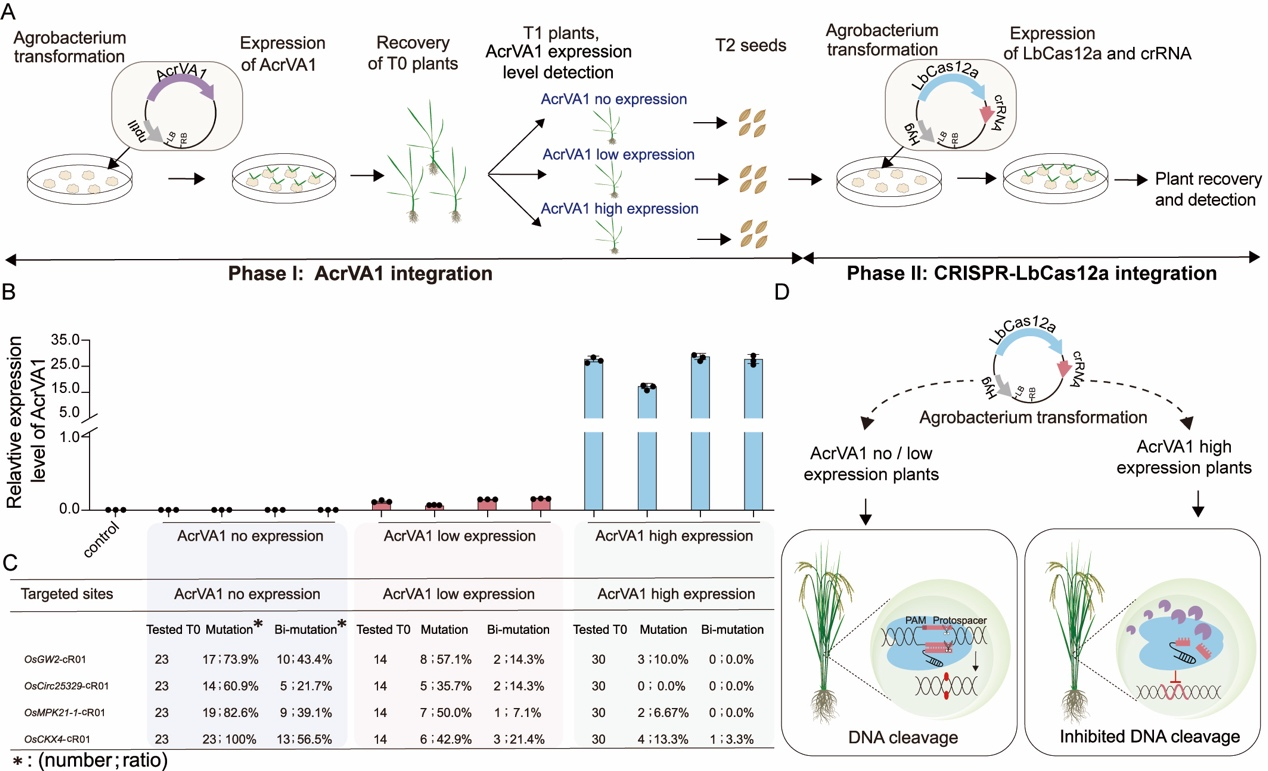
图4 表达AcrVA1的植物对Cas12a基因组编辑具有抗性
5、 AcrVA1的诱导和组织特异性表达对水稻LbCas12a基因组编辑实现时空调控
进一步地,作者设计了两种AcrVA1表达模式,一种是通过雌激素诱导型启动子(XVE启动子)控制(图5A和5B),另一种是通过根特异性启动子(OsRCc3启动子)控制(图5E和5F),以探索LbCas12a介导的基因组编辑的可调节性。在水稻原生质体中测试这些系统,发现常表达AcrVA1显著降低了LbCas12a的编辑效率。使用XVE启动子时,未添加β-estradiol前存在泄漏表达,添加后编辑效率显著降低,类似于AcrVA1持续表达的水平(图5C)。在稳定转基因植株中,通过化学诱导(β-estradiol)有效控制了LbCas12a基因组编辑(图5D)。使用根特异性启动子pOsRCc3驱动AcrVA1的表达并在水稻原生质体中进行了测试(图5E和5F),结果表明,当AcrVA1由根特异性启动子表达时,在叶细胞中未观察到基因组编辑效率的降低,而在根细胞中观察到了显著降低(图5G)。
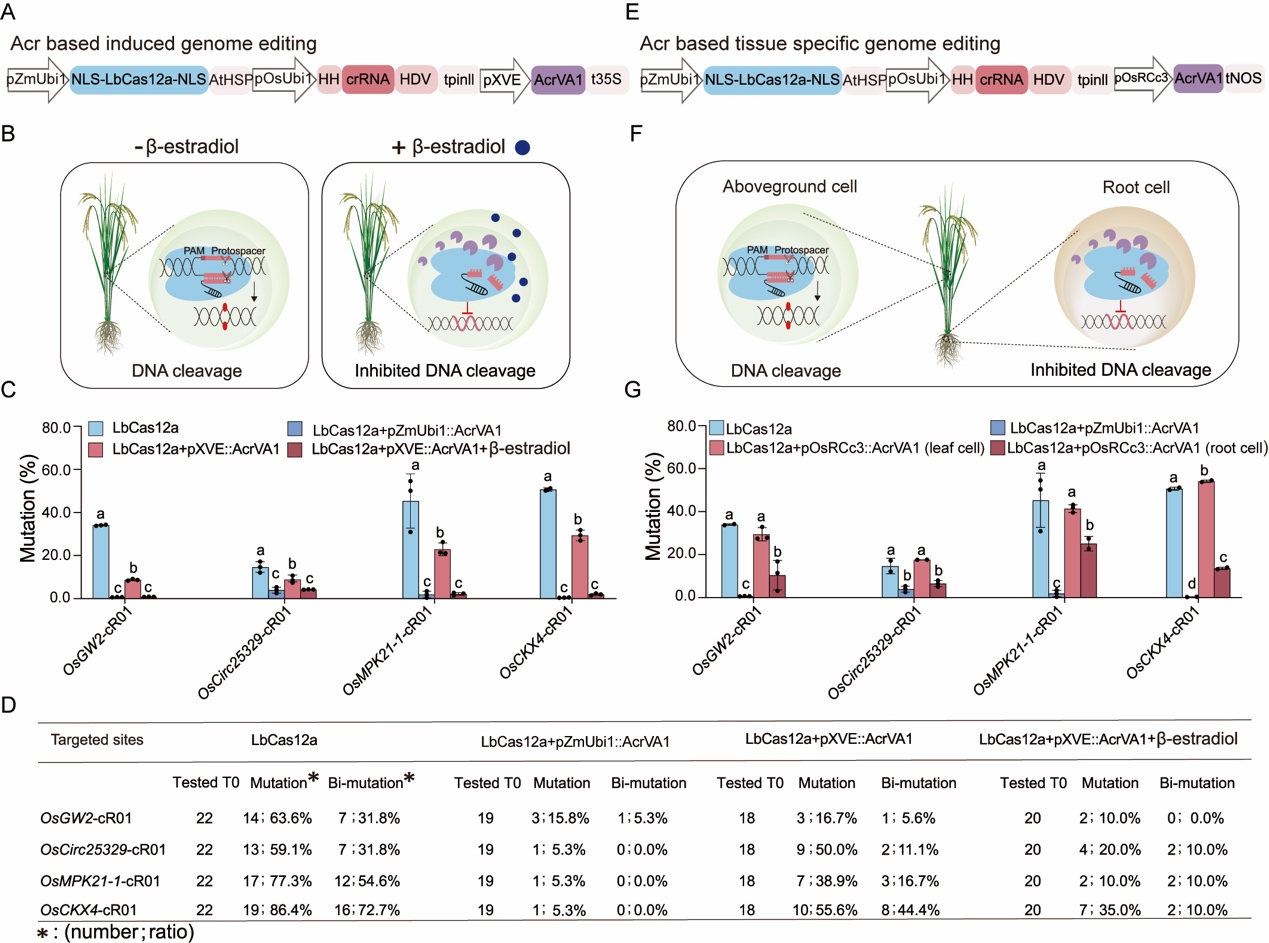
图5 利用LbCas12a和AcrVA1对水稻进行微调和组织特异性基因组编辑
6、 利用CRISPRa和Acr系统在植物细胞中构建合成遗传回路逻辑门
Cas12a因其T-rich PAM需求而成为高效的转录调控工具。作者评估了AcrVA1对基于LbCas12a的转录激活系统(CRISPRa)的影响,在共表达AcrVA1时,CRISPRa系统无法激活四个独立内源基因的表达,表明AcrVA1对CRISPRa有强烈的抑制作用(图6A和6B)。进一步地,作者尝试在植物细胞中通过精细控制CRISPRa及AcrVA1蛋白来设计植物合成遗传回路。作者设计了五种逻辑门组件,并基于组件设计了不同的合成遗传回路逻辑门(图6C和6D)。水稻原生质体实验显示,设计的逻辑门质粒产生的eYFP信号与预期的逻辑门功能一致,并可通过eYFP/mCherry荧光比值进行量化分析(图6E和6F)。作者还表达了针对OsER1、OsGW7、OsWaxy和OsMIR528启动子的crRNAs以实现转录激活调控。然而,作者发现在XVE启动子存在的情况下,无论是否添加β-雌二醇,CRISPRa都受到强烈抑制,这表明AcrVA1的泄漏表达对CRISPRa的干扰作用较强(图6G)。
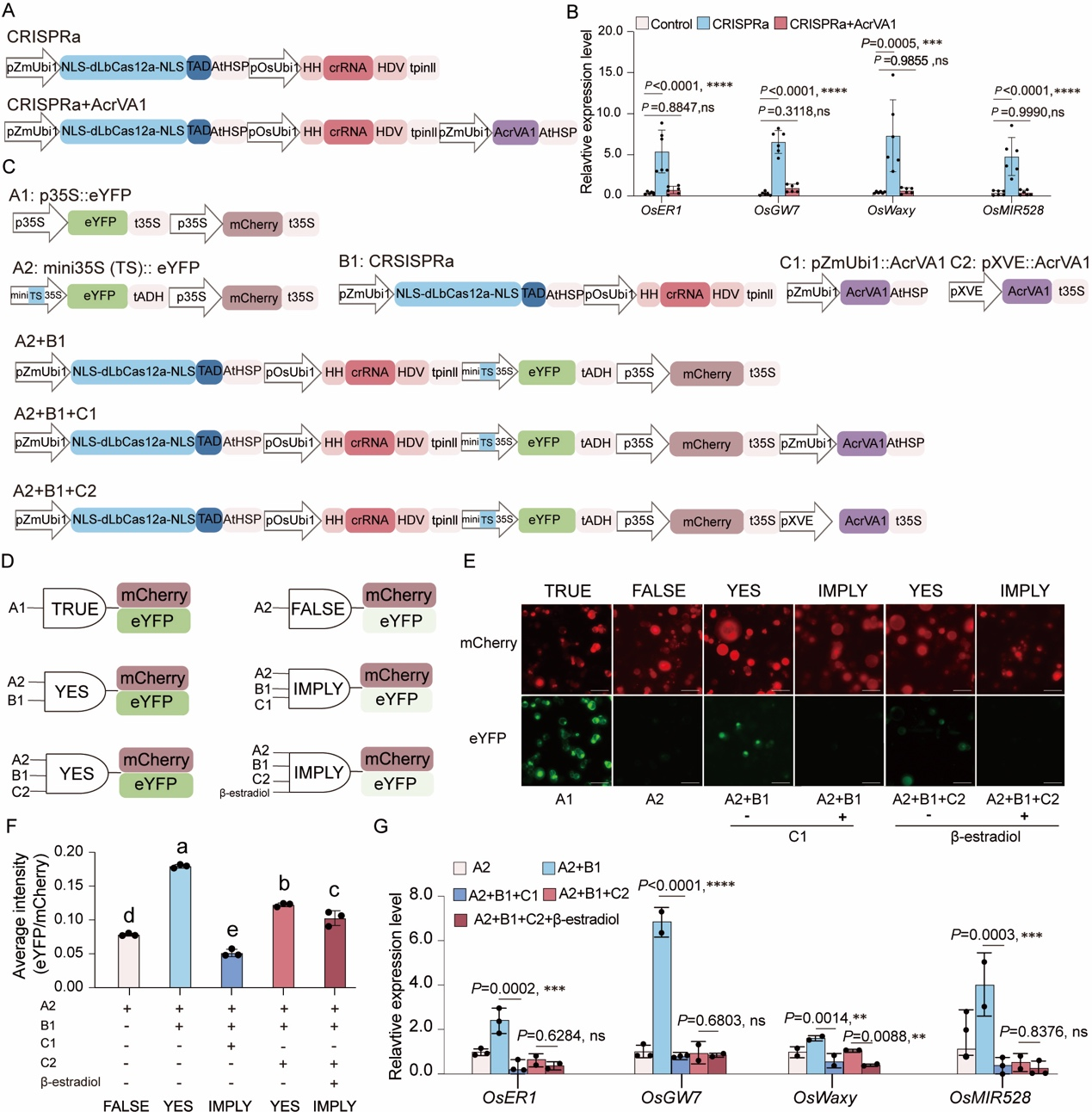
图6 AcrVA1对CRISPRa的有效抑制及其在构建植物合成遗传回路中的应用
西部(重庆)科学城种质创制大科学中心与西南大学联合培养博士后何瑶博士、电子科技大学刘诗诗博士及扬州大学博士研究生陈龙为论文共同第一作者。西南大学生命科学学院张勇教授、马里兰大学Yiping Qi教授、扬州大学张韬教授及武汉大学郭锋彪教授为论文共同通讯作者。研究工作得到了国家科技创新2030-“农业生物育种”重大专项、国家自然科学基金、四川省自然科学基金等项目资助。
论文链接:https://www.sciengine.com/SCLS/doi/10.1007/s11427-024-2704-7